中学校では、いろいろな気体の性質を勉強します。二酸化炭素(CO₂)の性質はよく理解できているでしょうか。
この記事では、「二酸化炭素とは」「二酸化炭素の性質」「二酸化炭素の化学反応」などについて解説しています。
それでは早速、「二酸化炭素(CO₂)」について一緒に学習していきましょう!
【はじめに】自己紹介
このサイトは、現役の中学教師である「たつや」が管理・運営しています。
このサイトは、教師である私が「より多くの人に科学の面白さを知ってもらいたい!」「中学生が理科を好きになるようなサイトをつくりたい!」という思いのもと執筆しています。
私の簡単な自己紹介はこちらです!
 |
| 現役の中学校教師 理科教育歴 5年 理科の中でも「生物」が大好き! サイト運営 2021年7月~ 座右の銘は「不言実行」 |
まだまだ発展途上のサイトで、至らない点も多くあるかと思いますが、これからも「かめのこブログ」をよろしくお願いいたします(^○^)
私の詳しいプロフィールはこちらから!
0. 関連記事 一覧
中1(気体の性質)と中2(化学反応)の単元に関係する記事の一覧です!
今、学習している内容がどこにあたるか確認しておきましょう!
1. 二酸化炭素とは
① 空気中の二酸化炭素(中1)
空気中には、様々な気体が存在します。空気中に含まれる気体を多い順に並べると、下のようになります。
「窒素(約78%)」「酸素(約21%)」「アルゴン(約1%)」「二酸化炭素(約0.03%)」
このように、空気中の気体のうち、二酸化炭素は4番目に多く含まれる気体です。
また、二酸化炭素は、地球の気温をあげる「温室効果」をもっています。
② 二酸化炭素の化学式(中2)
二酸化炭素は、その名の通り「酸素原子(O)が2つ」と「炭素原子(C)が1つ」がくっついてできています。
そのため、二酸化炭素を化学式で表すと、「CO₂」と表します。読み方は「シーオーツー」です。
③ 光合成と二酸化炭素(中2)
「光合成」の化学反応式は以下の通りです。
二酸化炭素(CO₂) + 水(H₂O) → デンプン + 酸素(O₂)
このように、光合成では「二酸化炭素(CO₂)」と「水(H₂O)」を材料に、「デンプン」がつくられます。そして、その反応の過程で「酸素(O₂)」が排出されます。
より詳しく「光合成」について学習したい方は下の解説を参考にしてください。

④ 呼吸と二酸化炭素(中2)
「呼吸」の化学反応式は以下の通りです。
有機物 + 酸素(O₂)→ 二酸化炭素(CO₂) + 水(H₂O) + (エネルギー)
このように、呼吸では、有機物と酸素を材料に、エネルギーをつくります。その過程で二酸化炭素と水が排出されます。
これを中学では、「細胞による呼吸(細胞呼吸)」といいます。
より詳しく「呼吸」ついて学びたい人は下の記事を参考にしてください。

2. 性質と特徴
① 性質と特徴(中1)
二酸化炭素の基本的な性質は、次の6点です。
・水に少し溶ける
・水に溶けると酸性を示す
・空気より重い
(水の比重を1.0とすると、二酸化炭素は1.49)
・二酸化炭素の固体は「ドライアイス」である。
・水に二酸化炭素を溶かすと「炭酸水」になる。
・石灰水(水酸化カルシウム水溶液)を白くにごらせる
これらの性質や特徴はテストでもよく出題されるので、必ず覚えておきましょう!
② 集め方(中1)
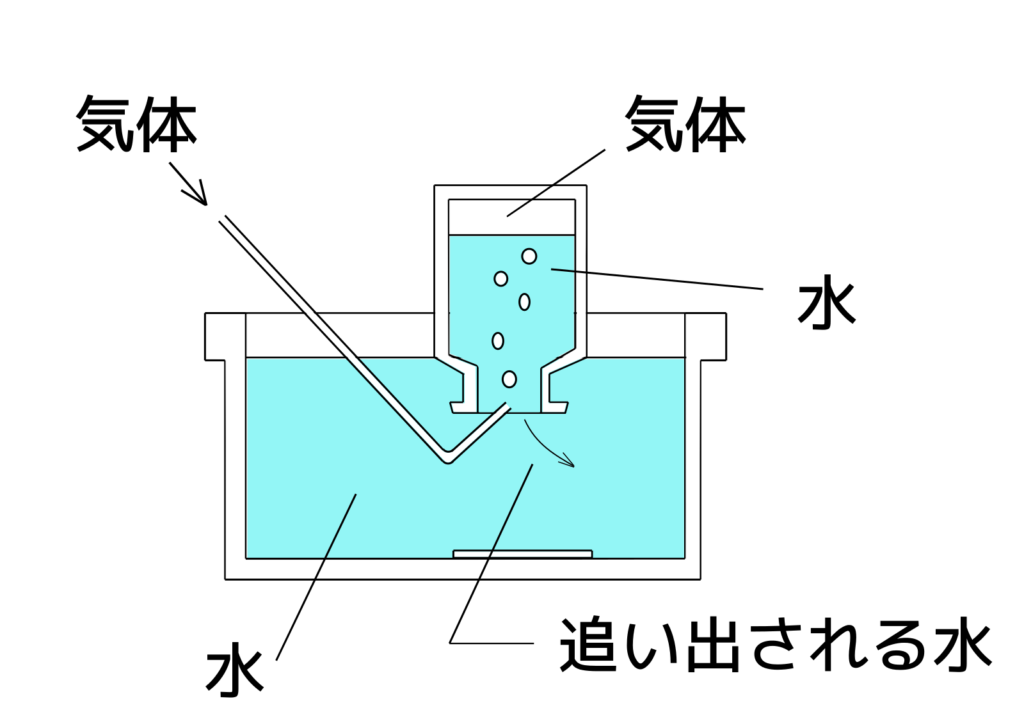
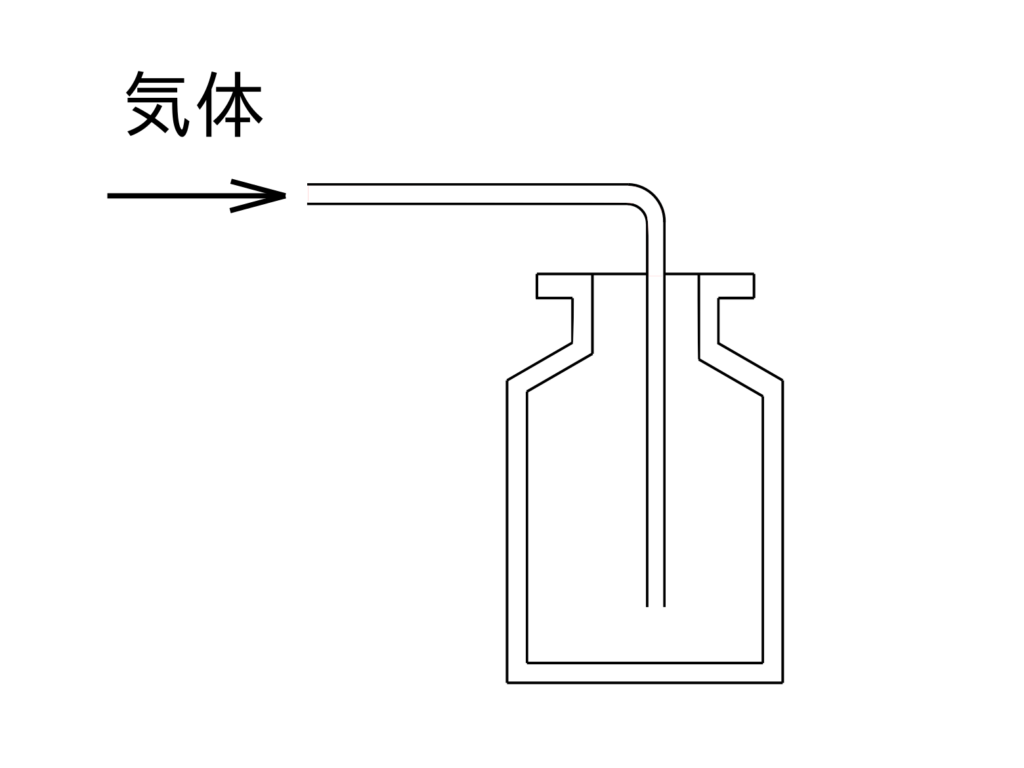
二酸化炭素は、「水に少しとける」や「空気より重い」という性質があります。
そのため、「水上置換法」または「下方置換法」で集めます。
それぞれの方法を図で確認しておきましょう。
●水上置換法(「水に溶けにくい気体」を集めるのに適した方法)
●下方置換法(「空気より重い気体」を集めるのに適した方法)
他の気体の集め方も詳しく知りたい方は、下の「気体の集め方」を参考にしてください。

③ 発生方法(中1・2)
二酸化炭素の発生方法は、主に次の4つです。
(1)石灰石にうすい塩酸をかける
(2)貝殻やチョークにうすい塩酸をかける
(3)炭酸水素ナトリウムを加熱する
(4)炭酸水を加熱する
それぞれの方法について詳しくみていきましょう!
(1)石灰石にうすい塩酸をかける
「石灰石」は、主に「炭酸カルシウム(CaCO₃)」からなる鉱物です。
石灰石にうすい塩酸をかけると、化学反応が起きて「二酸化炭素」が発生します。
(2)貝殻やチョークにうすい塩酸をかける
「貝殻」や「チョーク」も石灰石と同じように、主に「炭酸カルシウム(CaCO₃)」でできています。
そのため、貝殻やチョークにうすい塩酸をかけると、石灰石と同様に、「二酸化炭素」が発生します。
(3)炭酸水素ナトリウムを加熱する
「炭酸水素ナトリウム(NaHCO₃)」を加熱する実験は、よくテストでも出題されるので、化学反応式も覚えておきましょう。
炭酸水素ナトリウムの加熱の化学反応式は以下の通りです。
2NaHCO₃ → Na₂CO₃ + H₂O + CO₂
炭酸水素ナトリウム → 炭酸ナトリウム + 水 + 二酸化炭素
このように、「炭酸水素ナトリウム」を加熱すると、「炭酸ナトリウム」「水」「二酸化炭素」が発生します。
(4)炭酸水を加熱する
炭酸水は、水と二酸化炭素に圧力をくわえると、「炭酸(H₂CO₃)」ができることでつくられます。
炭酸は加わっていた圧力がなくなると、だんだんと水と二酸化炭素に分離し、二酸化炭素は気泡として水の中からでてきます。
炭酸水を加熱すると、「炭酸(H₂CO₃)」が急速に分解され、「二酸化炭素(CO₂)」が放出されます。
3. 化学反応式(中2)
最後に、中学校ででてくる「二酸化炭素」に関係する化学反応式を確認していきましょう!
① 化合
| 実験内容 | 化学反応式 |
| 炭素の完全燃焼 | C + O₂ → CO₂ (炭素 + 酸素 → 二酸化炭素) |
② 分解
| 実験内容 | 化学反応式 |
| 炭酸水素ナトリウムの分解 | 2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O (炭酸水素ナトリウム → 炭酸ナトリウム + 二酸化炭素 + 水) |
③ 還元
| 実験内容 | 化学反応式 |
| 酸化銅の還元(炭素) | 2CuO + C → 2Cu + CO₂ (酸化銅 + 炭素 → 銅 + 二酸化炭素) |
| 酸化鉄の還元(炭素) | 2Fe₂O₃ + 3C → 4Fe + 3CO₂ (酸化鉄(Ⅱ) +炭素 → 鉄 + 二酸化炭素) |
| 二酸化炭素の還元 | CO₂ + 2Mg → C + 2MgO (二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム) |
④ その他
| 実験内容 | 化学反応式 |
| 塩酸と炭酸カルシウムの反応 | 2HCl + CaCO₃ → CaCl₂ + CO₂ + H₂O (塩酸 + 炭酸カルシウム → 塩化カルシウム + 二酸化炭素 + 水) |
| 塩酸と炭酸水素ナトリウムの反応 | HCl + NaHCO₃ → NaCl + CO₂ + H₂O (塩酸 + 炭酸水素ナトリウム → 塩化ナトリウム + 二酸化炭素 + 水) |
| エタノールの燃焼 | C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O (エタノール + 酸素 → 二酸化炭素 + 水) |
| 石灰石と塩酸の反応 | CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O (石灰石 + 塩酸 → 塩化カルシウム + 二酸化炭素 + 水) |
| 炭酸水素ナトリウムと塩酸の反応 | NaHCO₃+ HCl → NaCl + CO₂ + H₂O (炭酸水素ナトリウム + 塩酸 → 塩化ナトリウム + 水) |
4. まとめ
今回は、「二酸化炭素(CO₂)の性質と化学反応」について解説しました!
様々な単元で出てくることからも二酸化炭素が身近な物質であることがお分かりいただけたでしょうか。
最後まで読んでいただき、ありがとうございました!
















