中学校の理科で習った「酸化と還元」はよく理解できていますか?
この記事では「酸化・還元・燃焼とは」「酸化・還元・燃焼の例」などをわかりやすく解説しています。
それでは早速、「酸化と還元、燃焼」について一緒に学習していきましょう!
1. 酸化とは
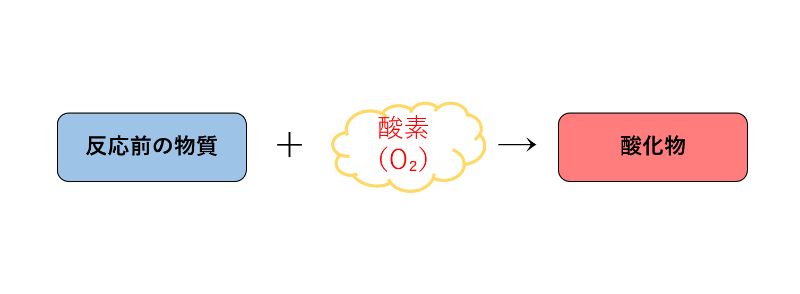
「酸化(さんか)」とは、物質が酸素とくっつく反応のことです。
理科では、物質が他の物質と反応してくっつくことを「化合(かごう)」ともいいます。
また、酸化によってできた酸素を含む物質を「酸化物(さんかぶつ)」といいます。
酸化を簡単に図で表すと下のようになります。
2. 身近な酸化の例
身近な酸化の例として、鉄(てつ)の酸化があります。
「鉄(Fe)」は「酸素(O₂)」とくっつき酸化するとサビます。この時にできるサビは「酸化鉄(FeO)」という物質です。
鉄の酸化を化学反応式で表すと次のようになります。
鉄 + 酸素 → 酸化鉄
(2Fe + O2 → 2FeO)
この時にできた「酸化鉄(FeO)」は酸化物になります。
3. 燃焼とは
「燃焼(ねんしょう)」とは、熱や光が出る激しい酸化のことです。
熱や光が出るってどういうことだろう?
燃焼について理解したい時には「焚き火」を想像するといいよ!
焚き火ってキャンプファイヤーみたいなやつ、、?
木に火をつけた焚き火を想像してみてください。
焚き火では、木が 「酸素」とくっついて、木の酸化が起こっています。
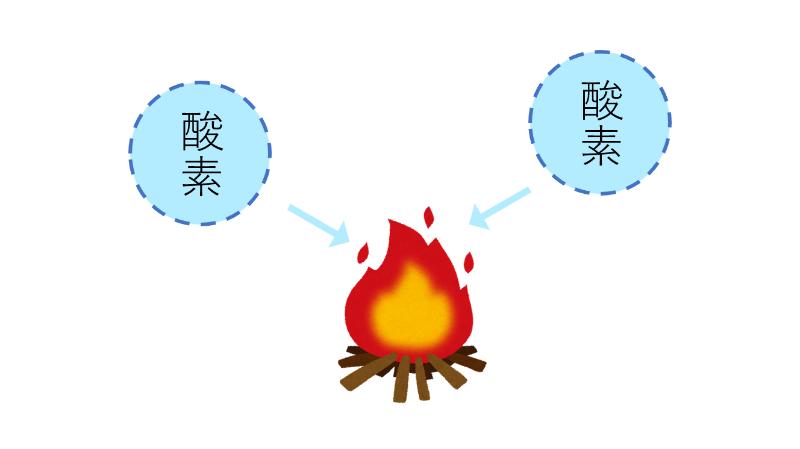
木と酸素がくっつく時には、炎が上がります。
炎は、「手を近づけると温かい」「暗い場所では周りを照らす」などの特徴があることから、「熱」や「光」を出しているといえます。
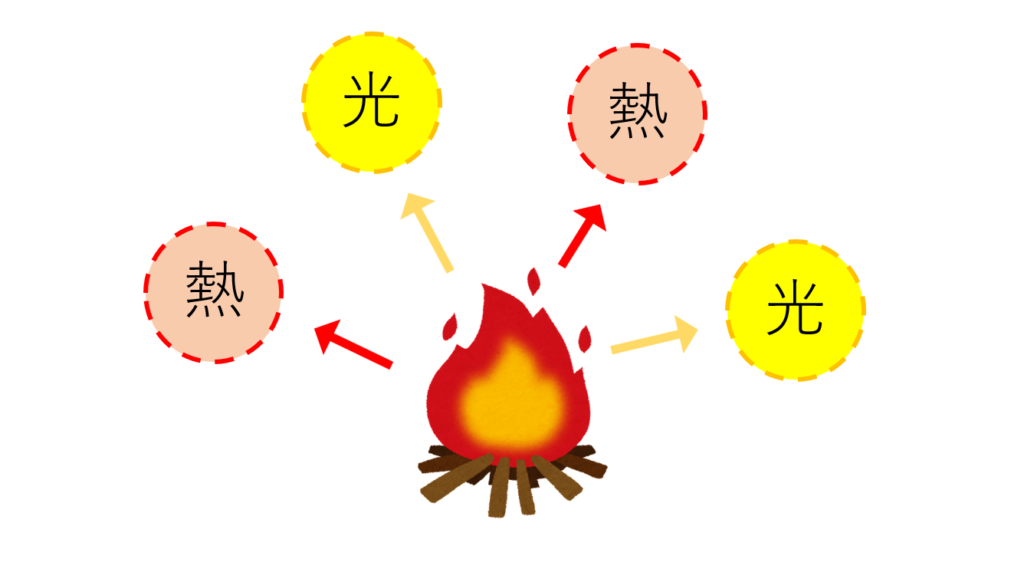
したがって焚き火では、酸化の時に熱や光が出ているので、木は「燃焼」しているといえます。
4. 酸化・燃焼の化学反応一覧
「酸化」や「燃焼」には、次のような化学反応があります。
どの反応も「酸素」と反応して、「酸化物」ができています。
| 内容 | 化学反応式 |
|---|---|
| スチルウール(鉄)の酸化 (燃焼) | 2Fe + O₂ → 2FeO (鉄+酸素→酸化鉄) |
| 銅の酸化 | 2Cu + O₂ → 2CuO (銅+酸素→酸化銅) |
| 炭素の酸化 | C + O₂ → CO₂ (炭素+酸素→二酸化炭素) |
| マグネシウムの酸化 (燃焼) | 2Mg + O₂ → 2MgO (マグネシウム+酸素→酸化マグネシウム) |
| 水素の酸化 (燃焼) | 2H₂ + O₂ → 2H₂O (水素+酸素→水) |
この表の中で、「スチルウール(鉄)の酸化」「マグネシウムの酸化」「水素の酸化」は反応するときに熱や光がでるため、燃焼にあたります。
5. 還元とは
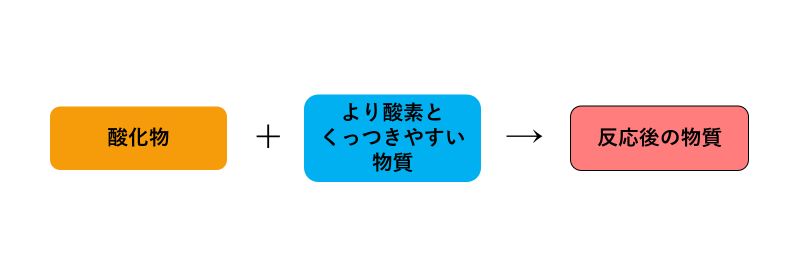
「還元(かんげん)」とは、酸素を含む物質(酸化物)から酸素が取り除かれる反応のことです。
つまり、酸化の逆が還元です。
還元では、「酸化物」と「より酸素とくっつきやすい物質」が反応することで、酸化物に含まれていた酸素が別の物質に移ることがおおいです。
還元を簡単に図で表すと次のようになります。
7. 還元の化学反応一覧
最後に、「還元」の化学反応の例を紹介していきます!
下の反応では、「酸化物」と「より酸素とくっつきやすい物質」の組み合わせになっているものが多いです。
| 内容 | 化学反応式 |
| 酸化銅の 炭素による還元 | 2CuO + C → 2Cu + CO₂ (酸化銅 + 炭素 → 銅 + 二酸化炭素) |
| 酸化銅の 水素による還元 | CuO + H₂ → Cu + H₂O (酸化銅 + 水素 → 銅 + 水) |
| 酸化銀の還元 | 2AgO → 2Ag + O₂ (酸化銀 → 銀 + 酸素) |
| 二酸化炭素の マグネシウムによる還元 | CO2 + 2Mg → C + 2MgO (二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム) |


















