中学校の理科では、「飽和水溶液」について学習しますが、よく理解できていますか?
この記事では「飽和水溶液とは」についてわかりやすく解説しています。
それでは早速「飽和水溶液」について一緒に学習していきましょう!
1. 飽和水溶液とは
「飽和水溶液(ほうわすいようえき)」とは、ある温度・圧力で限界まで物質を溶かした水溶液のことです。
例えば、水に食塩をいれて食塩水をつくる場合について考えてみましょう。
水に少しでも食塩をいれれば食塩水ができますが、食塩をどんどんいれていくと、いずれそれ以上溶けなくなります。
どんなにかき混ぜたり、時間が経ってもそれ以上溶けなくなった状態になれば「飽和水溶液」の完成です。
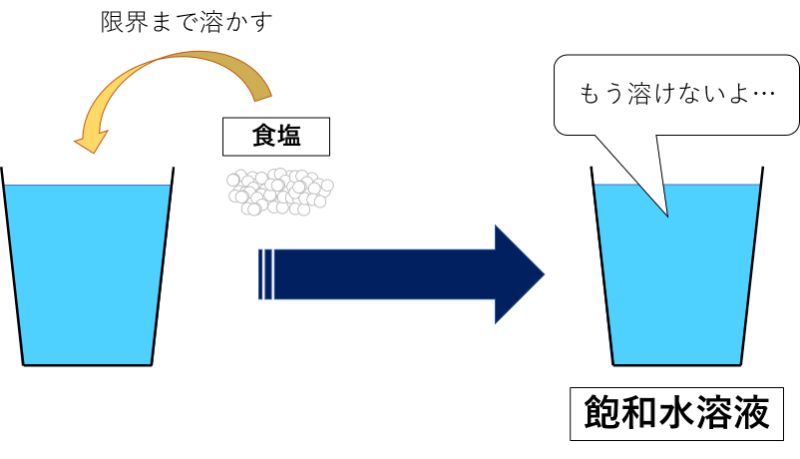
食塩は20℃の時、水100 g に約 36 g 溶けます。
したがって、20℃の時の食塩の飽和水溶液の質量パーセント濃度は約26%となります。
100 gの水に溶ける量は物質によって違い、100g以上溶けるものから1gも溶けないものまで様々です。
物質が水100 gに溶ける量のことを「溶解度」といいます。
物質の溶解度についてより詳しく知りたい方は、下の「溶解度・飽和水溶液と再結晶についてわかりやすく解説!」を参考にしてください。

溶解度・飽和水溶液と再結晶についてわかりやすく解説!【中学 理科】
水への物質ごとの溶けやすさを「溶解度」といいますが、食塩と砂糖のどちらの方が溶解度が高いか知っていますか?
この記事では、「溶解...
















