中学校では、いろいろな気体の性質を勉強します。水素(H2)の性質はよく理解できているでしょうか。
この記事では、「水素とは」「水素の性質と特徴」「水素の化学反応」などについて解説しています。
それでは早速、「水素の性質」について一緒に学習していきましょう!
【はじめに】自己紹介
このサイトは、現役の中学教師である「たつや」が管理・運営しています。
このサイトは、教師である私が「より多くの人に科学の面白さを知ってもらいたい!」「中学生が理科を好きになるようなサイトをつくりたい!」という思いのもと執筆しています。
私の簡単な自己紹介はこちらです!
 |
| 現役の中学校教師 理科教育歴 5年 理科の中でも「生物」が大好き! サイト運営 2021年7月~ 座右の銘は「不言実行」 |
まだまだ発展途上のサイトで、至らない点も多くあるかと思いますが、これからも「かめのこブログ」をよろしくお願いいたします(^○^)
私の詳しいプロフィールはこちらから!
0. 「気体の性質」の記事 一覧
「気体の性質」の単元に関係する記事の一覧です!
今、学習している内容がどこにあたるか確認しておきましょう!
1. 水素とは
① 水素とは
水素は、原子番号1番の元素で、常温(20℃)では無色無臭の気体です。
水素は、「最も軽い気体」「可燃性がある」「燃えたときに二酸化炭素を出さない」などの性質から様々なところで活用されています。
② 用途
水素の主な用途は次の通りです。
「燃料電池」「液化水素(メタルハイドライド)」「燃料電池車の燃料」「宇宙ロケットの燃料」「太陽電池シリコン・液晶・光ファイバーの製造」
特に、身近に使われているのは「燃料電池車」かと思います。
燃料電池車とは、ガソリンを使わず、水素で走る車のことです。
2. 性質と特徴
① 基本的な性質と特徴
・無色、無臭の気体
・空気よりとても軽い(すべての気体の中で最も軽い)
・水に溶けにくい
・水素自体が燃える(可燃性)
水素の一番の特徴はなんといってもその軽さです。
水素は全ての元素の中で「最も軽い気体」で、昔は「飛行船」や「気球」を浮かせるためにも使われました。
しかし、水素には「可燃性」という性質もあり、危険な側面もあわせ持っていたため、現在では、二番目に軽い気体である「ヘリウム」に置き換えられています。
② 【詳しく!】水素の可燃性とは?
「水素」の「可燃性」とは、「その気体自体が燃えるということ」です。
イメージとしては、下の図のようになります。

水素自体が燃えるため、他の燃えるもの(紙など)と同じように、「酸素」がないともえません。
一方で「酸素」は、「助燃性」をもっており、物質が燃えるのを助けます。
イメージとしては、下のようになります。
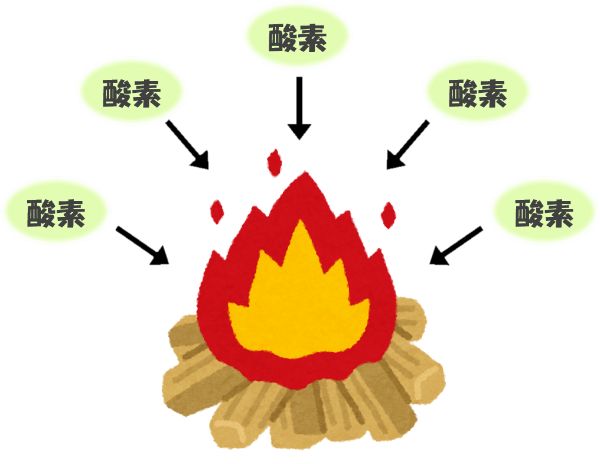
このように、水素の「可燃性」と酸素の「助燃性」は全く違うものなので、間違えないように注意しましょう。
③ 集め方
水素は、「水に溶けにくい」という性質があるため、「水上置換法」で集めます。
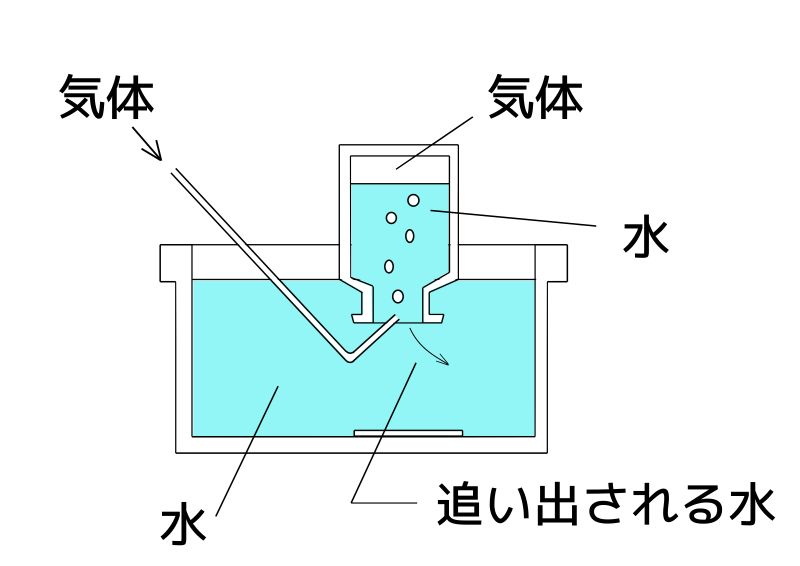
空気より軽いから、「上方置換法」でもいいんじゃないの?
そうなんだ!納得!
テストでも「水上置換法」と答えるようにしよう!
「気体の性質」や「気体の集め方」についてより詳しく知りたい方は、こちらを参考にしてください。


④ 発生方法
水素を発生させる方法は、次の通りです。
金属(金、銀、銅は除く) + うすい塩酸
詳しくは中学3年生で学習しますが、金属はうすい塩酸に入れることで少しずつ溶けていきます。
金属が溶ける時に、一緒に水素が発生します。
金属の例としては、「鉛」や「鉄」「アルミニウム」などがあります。
⑤ 【詳しく!】金・銀・銅が溶けない理由は?
なぜ、金・銀・銅は水素が発生しないの?
いいところに気がついたね!
金属には、溶けやすいものと溶けにくいものがあって、溶けにくいものでは水素が発生しにくいんだよ。
塩酸で溶けやすい順に金属を並べると次のようになります。
カルシウム > ナトリウム > マグネシウム > アルミニウム > 鉛 > 鉄 > 銅 > 銀 > 金
「カルシウム」や「ナトリウム」はとても反応しやすいため、水とも激しく反応します。
一方で、「金」「銀」「銅」は、反応しにくいため、塩酸ともあまり反応しません。
このことを高校で勉強する言葉では、「イオン化傾向」といいます。
3. まとめ
今回は、「水素の性質」について解説しました。
水素には、「最も軽い気体」や「水に溶けにくい」「水素自体が燃える(可燃性)」など様々な特徴があることが分かっていただけましたでしょうか。
それでは、最後まで読んでいただき、ありがとうございました!
水素は、将来を期待されたすごい気体だったね~!




















