中学校の理科では、「還元」について学習しますが、よく理解できていますか?
この記事では「還元とは」「還元の例」などをわかりやすく解説しています。
それでは早速、「還元」について一緒に学習していきましょう!
1. 還元とは
「還元(かんげん)」には、元に戻すという意味があります。
理科でいう「還元」とは、酸素を含む物質(酸化物)から酸素が取り除かれる反応のことです。
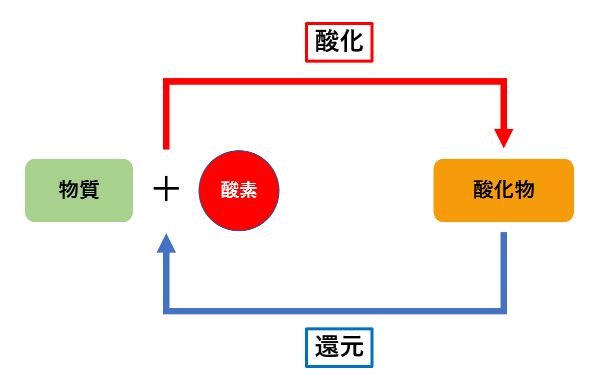
つまり、「酸化」の逆が「還元」になります。
酸化と還元の関係を簡単に図で表すと、次のようになります。
2. 還元の例
続いては、還元の化学反応の例を紹介していきたいと思います。
中学2年生で習う還元の化学反応にはどのようなものがあるか確認していきましょう!
還元では、酸化物をただ加熱するのではなく、「酸化物」と「より酸素とくっつきやすい物質」を一緒に加熱することで酸化物を還元します。
還元の化学反応を簡単に図に表すと、下のようになります。
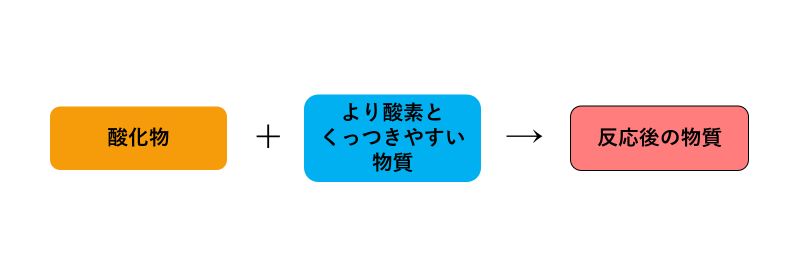
例えば、『酸化銅の炭素による還元』では、酸化物である「酸化銅(CuO)」と「炭素(C)」を一緒に加熱することで、酸化銅の還元を行ないます。
下の化学反応式で表した他の例もほとんどが「酸化物」と「より酸素とくっついやすい物質」の組み合わせになっています。
唯一、『酸化銀の還元』だけは例外で、酸素と銀の結びつきが非常に弱いため、加熱するだけで還元が起こります。
※スマホの方は画面を横にしてご覧ください。
| 内容 | 化学反応式 |
| 酸化銅の 炭素による還元 | 2CuO + C → 2Cu + CO₂ (酸化銅 + 炭素 → 銅 + 二酸化炭素) |
| 酸化銅の 水素による還元 | CuO + H₂ → Cu + H₂O (酸化銅 + 水素 → 銅 + 水) |
| 酸化銀の還元 | 2AgO → 2Ag + O₂ (酸化銀 → 銀 + 酸素) |
| 二酸化炭素の マグネシウムによる還元 | CO2 + 2Mg → C + 2MgO (二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム) |
3. 化学反応の種類
化学反応には、その特徴によって色々な種類があります。
「還元」以外にも「化合」「酸化」「燃焼」「分解」「中和」などの化学反応があります。
より詳しく「化学反応式の種類」や「化学反応式の書き方」について学習したい方は、下の記事も参考にしてください(^○^)


それでは、最後まで読んでいただきありがとうございました!!















