中学校の理科では、「吸熱反応」について学習しますが、よく理解できていますか?
この記事では「吸熱反応とは」「吸熱反応の例」などをわかりやすく解説しています。
それでは早速、「吸熱反応」について一緒に学習していきましょう!
1. 吸熱反応とは
「吸熱反応」とは、熱を吸収しながらおこる化学反応のことです。
吸熱反応では、下の図のように、周りの熱を吸収しながら反応が起こります。
そのため、反応が起こっている間、周りの温度は下がります。
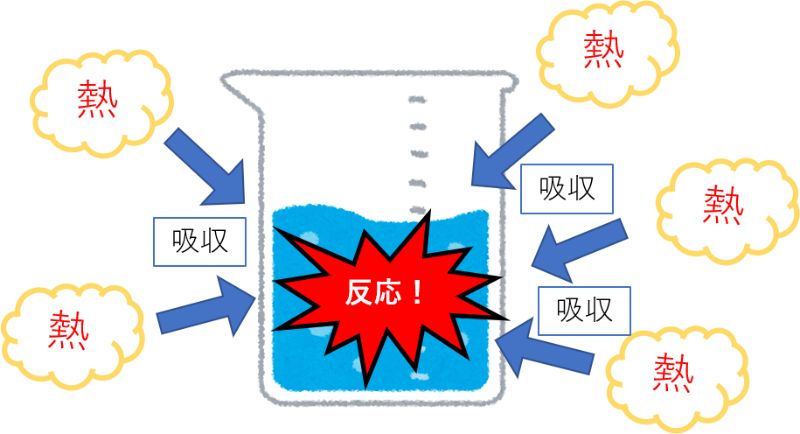
反応のときに熱を吸収するので、式で表すと次のようになります。
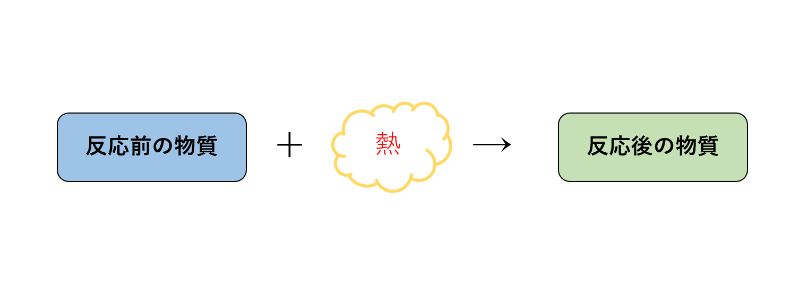
また、吸熱反応とは反対に、熱を出しながら起こる反応のことを「発熱反応」といいます。
2. 吸熱反応の例
吸熱反応は中学校の教科書にも載っており、色々な実験があります。
どのようなときに吸熱反応が起こるのか、確認していきましょう!
① 塩化アンモニウム+水酸化バリウム
一番有名なのが、「塩化アンモニウム(NH₄Cl)」と「水酸化バリウム(Ba(OH)₂)」の反応です。
この2つを混ぜることで、吸熱反応が起こり温度が下がります。
ちなみに、化学反応式は次のとおりです。
塩化アンモニウム + 水酸化バリウム → 塩化バリウム + 水 + アンモニア
(2NH₄Cl + Ba(OH)₂ → BaCl₂ + H₂O + NH₃)
② クエン酸 + 重曹(炭酸水素ナトリウム)
「クエン酸」と「重曹(炭酸水素ナトリウム)」を混ぜても吸熱反応が起こります。
クエン酸と重曹の化学反応式は次のとおりです。
クエン酸 + 重曹 → クエン酸ナトリウム + 水 + 二酸化炭素
(C₆H₈O₇ + 3NaHCO₃ → Na₃C₆H₅O₇ + 3H₂O + 3CO₂)
クエン酸と重曹の化学反応式は複雑なので、高校受験で出題される可能性はかなり低いので、余裕がある人だけ覚えましょう。
















