1. 質量保存の法則とは
「質量保存の法則」とは、化学変化の前後で物質全体の質量は変わらないという法則です。
化学変化の前と後での質量なんて気にしたことなかった、、
言葉だけじゃわからないから何か分かりやすい例はないかな?
そうだよね!
化学反応の前後の「原子の数」に注目すると分かりやすいよ!
例1. 鉄の加熱(鉄の酸化)
まずは例として、「鉄の加熱」について説明していきます。
鉄の加熱では、「鉄(Fe)」と「酸素(O)」が反応すると「酸化鉄(FeO)」ができます。
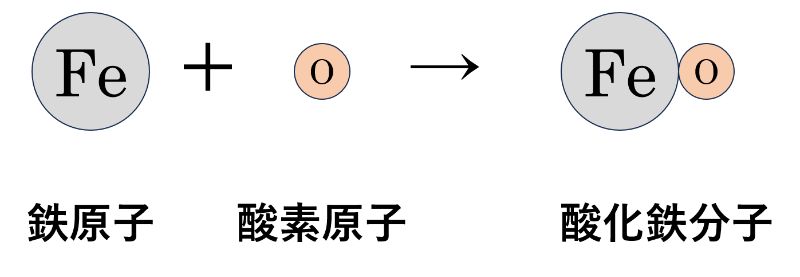
酸素は、「酸素分子(O₂)」の状態で存在しているので、実際の化学反応では、「鉄原子(Fe)」が2つと「酸素分子(O₂)」が1つで反応して、「酸化鉄の分子(FeO)」が2つできます。
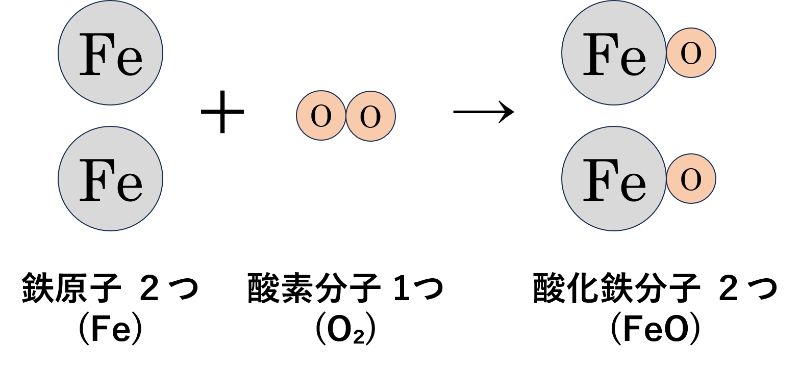
この時、化学変化の前後の原子を数えてみるとどちらも次のようになっています。
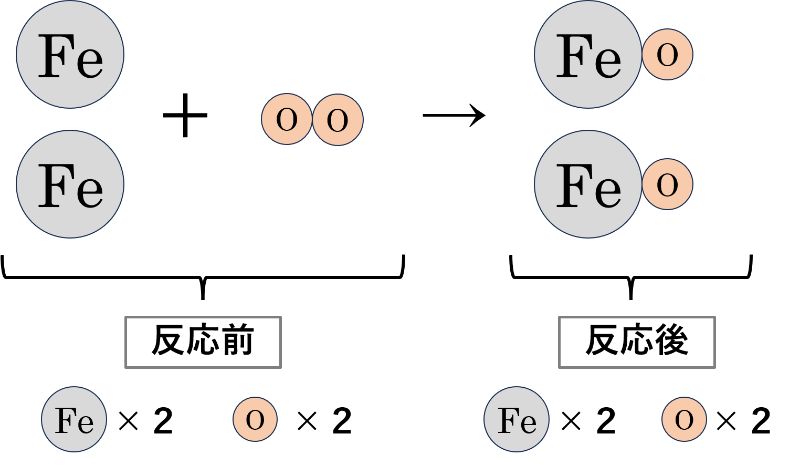
このように、化学変化の前後で原子の数を数えてみると、どちらも「Fe×2, O×2」となり、反応の前後で原子の数は変わっていないことが分かります。
このように、「化学反応の前後で原子の数が変わらない(=質量が変わらない)こと」を「質量保存の法則」といいます。
例2. 炭酸水素ナトリウムと塩酸の反応
続いては、「炭酸水素ナトリウム(NaHCO₃)」と「塩酸(HCl)」の反応です。
少し登場する原子の数が多いですが、考え方は例1と変わりません。
「炭酸水素ナトリウム(NaHCO₃)」と「塩酸(HCl)」は反応すると、「塩化ナトリウム(NaCl)」「二酸化炭素(CO₂)」「水(H₂O)」ができます。
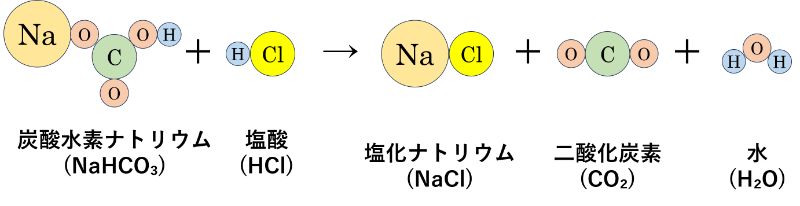
この時も化学変化の起こる前と起こった後の原子の数を比べると、どちらも次のようになります。
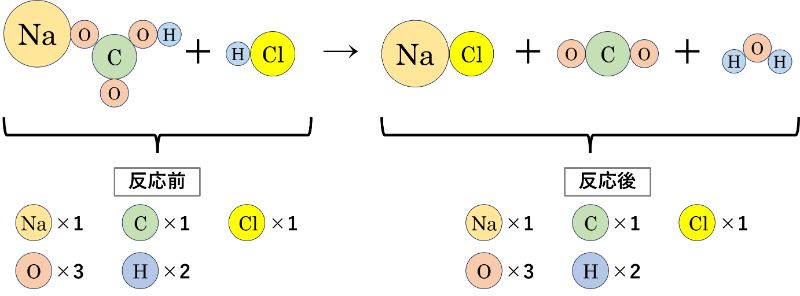
反応前の原子の数は「Na×1, C×1, Cl×1, O×3, H×2」。反応後の原子の数も「Na×1, C×1, Cl×1, O×3, H×2」です。
したがって、今回も「化学反応の前後で原子の数が変わらない(=質量が変わらない)」ので「質量保存の法則」が成り立っています。
しかし、ここで注意したいのは化学変化の時に「気体の二酸化炭素(CO₂)」ができるということです。
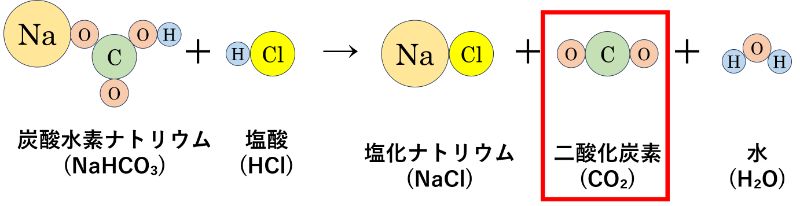
化学変化の前後の物質全体の質量を比べるので、実験で質量保存の法則を確かめるときには容器に密閉して行う必要があります。


















