物質には様々な化合物がありますが、化合物の融点・沸点は知っていますか?
この記事では、「融点・沸点とは」「化合物とは」「化合物の融点・沸点一覧」などについて解説しています。
それでは早速、一緒に「化合物の融点・沸点」について勉強していきましょう!
1. 物質の融点・沸点とは?
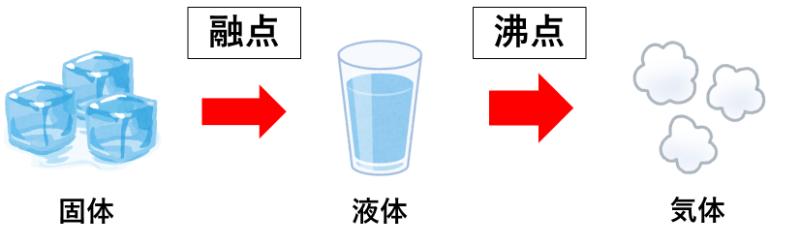
「融点(ゆうてん)」とは、固体が液体になる温度のことです。
例えば、氷(固体)が水(液体)にかわる温度は0℃です。
つまり、水という物質の融点は0℃ということになります。
「沸点(ふってん)」とは、液体が気体になる温度(沸点)のことです。
例えば、水(液体)が沸騰して、水蒸気(気体)になる温度は100℃です。
つまり、水という物質の沸点は100℃ということになります。
このように、物質にはそれぞれ融点と沸点があり、融点・沸点は物質ごとに決まっています。
状態変化と沸点・融点の関係は次のようになります。
2. 化合物とは?
「化合物(かごうぶつ)」とは、「2種類以上の元素からできている物質」のことです。
化学式で表すと、2種類以上の元素記号を使って表すことになります。
例えば、化合物である「水」は、化学式では「H₂O」と書きます。
このとき、元素記号は「H(水素)」と「O(酸素)」の2種類が使われており、水が水素と酸素からできているということが分かります。
3. 化合物の融点・沸点 一覧
今回は、中学校や高校でよく使う化合物、身近にある化合物の融点・沸点を紹介していきます!
化合物は2種類以上の元素を含んでいるため、明確な融点・沸点がないなど色々な性質のものがあります。
備考には、融点・沸点に関係する大切な情報を書きました!備考も合わせて確認してください!
| 物質名 | 化学式 | 融点(℃) | 沸点(℃) | 備考 |
|---|---|---|---|---|
| 水 | H₂O | 0 | 100 | |
| 二酸化炭素 | CO₂ | -56.6 | -78.5 | |
| アンモニア | NH₃ | -77.7 | -33.4 | |
| 酸化銅 | CuO | 1201 | 2000 | |
| 酸化銀 | Ag₂O | 300 | 200℃以上で酸素と銀の分解が始まる。 分解されるため、沸点はない。 | |
| 酸化マグネシウム | MgO | 2852 | 3600 | |
| 水酸化ナトリウム | NaOH | 318 | 1388 | |
| 塩化ナトリウム(食塩) | NaCl | 800 | 1413 | |
| 塩化水素 | HCl | -114 | -85.1 | |
| 硫酸 | H₂SO₄ | 10.4 | 290 | |
| 酢酸 | CH₃COOH | 16.6 | 118 | |
| 炭酸水 | H₂CO₃ | -55.6 | -78.5 | 炭酸は溶液中のみで存在できるので、炭酸水について記載した。 |
| 炭酸水素ナトリウム | NaHCO₃ | 50 | 加熱すると分解されるので沸点なし。 粉末は270℃で分解がはじまる。 水溶液は65℃以上で急速に分解される。 | |
| 炭酸ナトリウム | Na₂CO₃ | 851 | 1600 | 無水物の場合の融点・沸点を記載。 水和物になると融点・沸点は変わる。 |
| ガラス (二酸化ケイ素) | SiO₂ | 400~1300 | 明確な融点・沸点はない。 400℃以上で柔らかくなり始め、1300℃以上でドロドロになる。 | |
| エタノール | C₂H₆O | -114 | 78.3 | |
| 一酸化炭素 | CO | -205 | -192 | |
| 過酸化水素 | H₂O₂ | -11 | 141 | 90%水溶液の場合を記載。 |
















